
文献速递 | 柯学课题组发现纳米结构脂质载体在毛囊靶向中的重要作用
2024年10月24日文献速递 | 华子春课题组开发双工程巨噬细胞-微生物包裹疗法用于抗肿瘤免疫治疗


研 究 亮 点
1.基因工程改造巨噬细胞以在其外膜表面产生RGD肽(R-GEM细胞)。RGD肽可以与在肿瘤细胞表面高度表达的αvβ3整合素结合,增强R-GEM细胞的瘤内富集。
抗肿瘤细菌减毒的鼠伤寒沙门氏菌VNP20009(VNP)被包裹在这些巨噬细胞中,导致R-GEM/VNP细胞的形成。此外利用基因工程改造VNP得到分泌FNγ菌株。最终得到了R-GEM/VNP-IFNγ细胞。
2.细胞内的细菌可以存活较长的时间并实现延迟释放。它们通过巨噬细胞趋化性和RGD介导的粘附有效地集中在肺转移瘤内。释放的VNP-IFNγ菌株通过增强抗肿瘤免疫反应来抑制肿瘤进展。
转移的特征是癌细胞在远离其起源的器官中增殖,是癌症的致死原因所在,近90%的癌症相关死亡主要是由于转移而不是原发性肿瘤导致。肺通常是源自胸外癌(包括乳腺癌、结肠癌和黑色素瘤)转移的部位。
在休眠期,转移的肿瘤细胞不会产生可见的病变或表现出明显的临床症状,由于转移的隐蔽进展,诊断时会出现大量肿瘤。此外,肺部独特的生理条件阻碍了药物的滞留和给药后的及时性,使治疗方法更为复杂。
免疫抑制微环境加剧了这一困难,凸显了开发针对肺转移瘤的精确和持久治疗策略的迫切性。
- R-GEM(RGD修饰底盘巨噬细胞)细胞的制备与表征
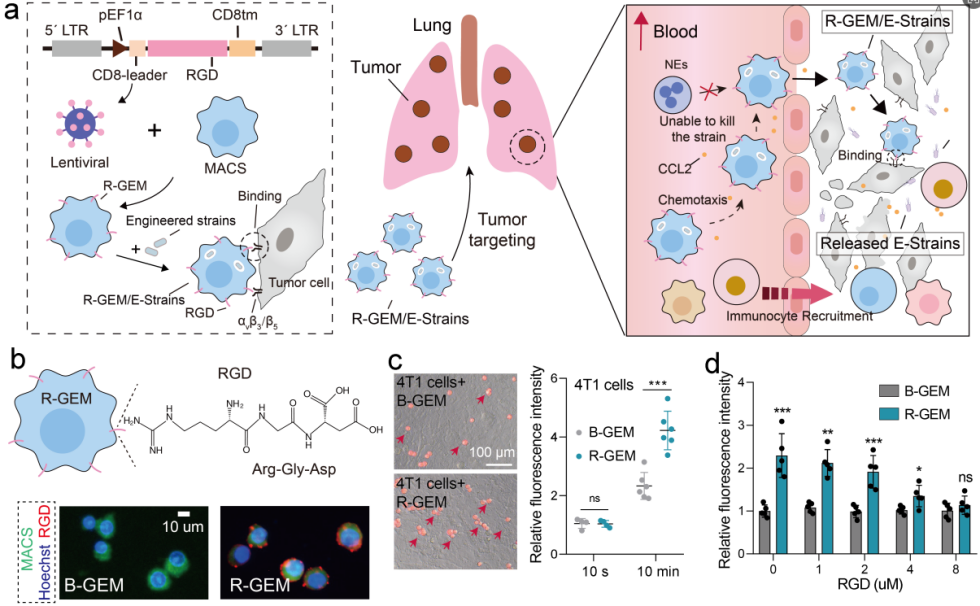
图1R-GEM细胞(病毒改造实现细胞外膜表达RGD蛋白)可强效粘附肿瘤细胞
精氨酸-甘氨酸-天冬氨酸(RGD)肽通过慢病毒方法在巨噬细胞系膜上稳定表达。RGD可与肿瘤细胞表面高表达的整合素αv及其异二聚体的特异性结合。
在筛选的细胞中证实了RGD成功定位在细胞膜上,这种RGD修饰的基因工程巨噬细胞被命名为R-GEM。
- R-GEM在体内高效靶向肺部肿瘤
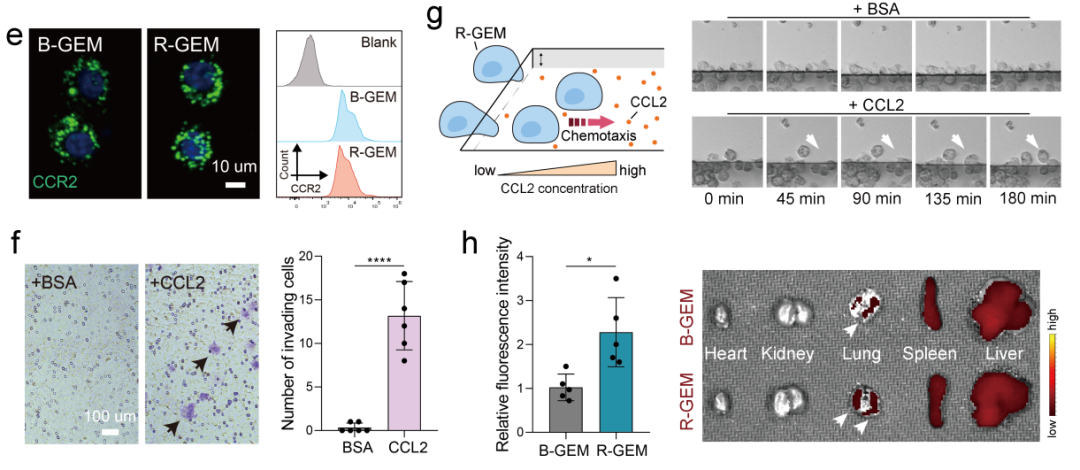
图2R-GEM细胞有效富集于肿瘤肺部转移灶
关键趋化因子受体CCR2在R-GEM细胞中仍然高表达。Transwell试验与动态成像证明了R-GEM细胞的趋化能力。
将DiR标记的R-GEM细胞通过尾静脉注射到患有4T1肿瘤细胞转移的小鼠体内。与B-GEM(空载对照细胞)细胞相比,R-GEM细胞在肿瘤转移灶中的富集显著提高
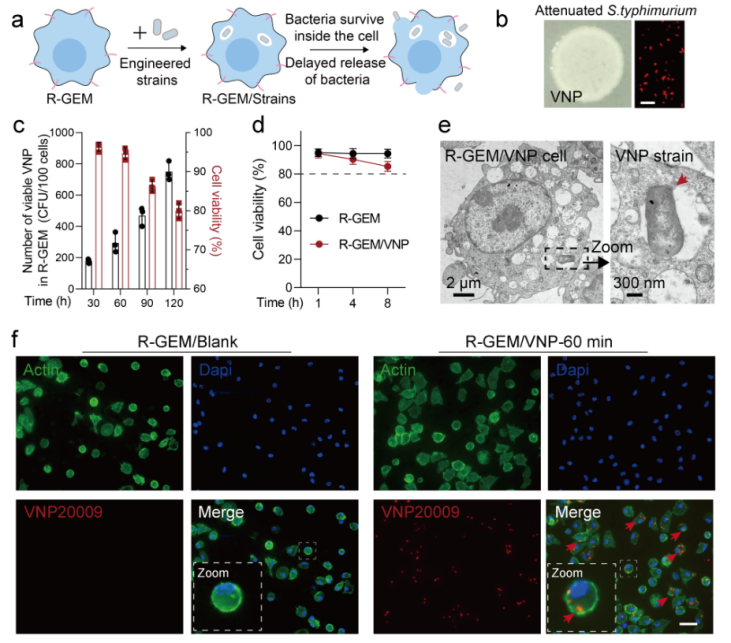
图3双工程巨噬细胞-微生物包裹系统的制备
- 双工程巨噬细胞-微生物封装(Du-EMME)系统的肿瘤靶向效果
R-GEM/VNP细胞在趋化因子CCL2的作用下表现出有效的趋化运动能力,其表现出优越的VNP菌株肿瘤富集效应,
而简单将R-GEM细胞与VNP菌株混合(R-GEM+VNP组)并没有实现与R-GEM/VNP组类似的细菌肿瘤富集增强。
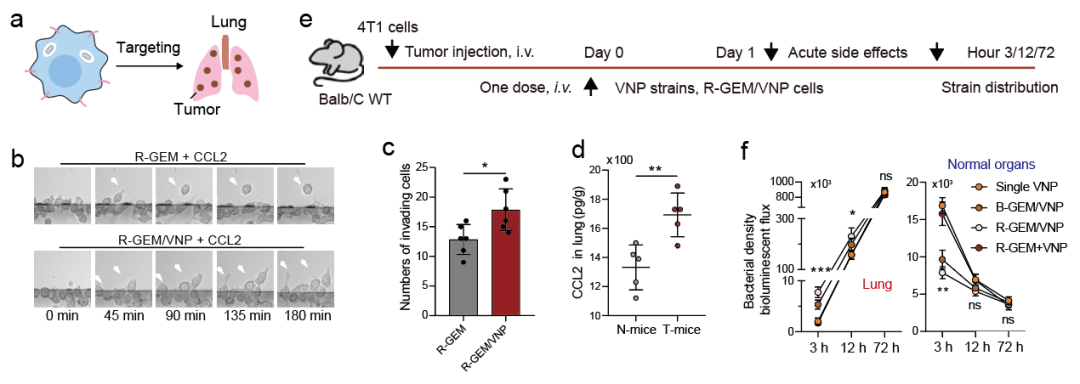
图4双工程巨噬细胞-微生物包裹系统高效靶向肺部肿瘤
- 双工程巨噬细胞-微生物封装(Du-EMME)系统实现多种肺转移瘤治疗
为了增强这种新型细胞疗法的抗癌功效,基于野生型VNP菌株设计了一种工程菌株VNP-IFNγ,以产生IFNγ。
随后制备获得R-GEM/VNP-IFNγ细胞。在三种小鼠模型(乳腺癌、黑色素瘤和结肠直肠癌)中,R-GEM/VNP-IFNγ细胞疗法均可有效阻止肺转移性肿瘤进展。

图5双工程巨噬细胞-微生物包裹系统实现高效的抗癌治疗(乳腺癌肺转移)
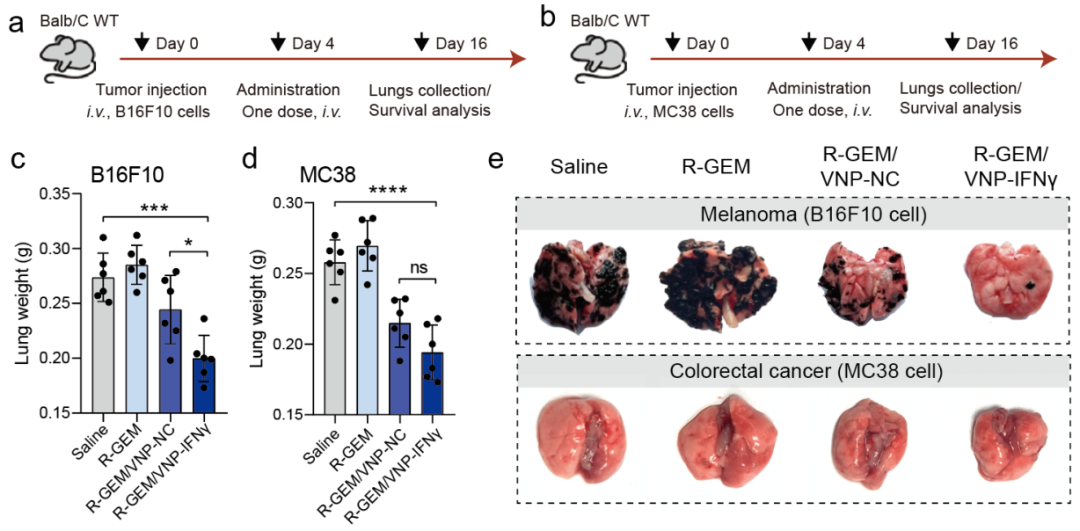
图6双工程巨噬细胞-微生物包裹系统实现高效的抗癌治疗(黑色素瘤/结直肠癌肺转移)
小 结
该研究开发了双工程巨噬细胞-微生物封装(Du-EMME)创新抗癌疗法,其中膜修饰工程巨噬细胞与活微生物试剂协同作用,用于转移瘤的靶向和持久治疗。具体来说,通过慢病毒感染产生巨噬细胞(R-GEM细胞),在其外膜表面上产生RGD肽。
RGD肽可以与αvβ3整合素结合,αvβ3整合素在肿瘤细胞表面高度表达,增强R-GEM细胞的瘤内富集。抗肿瘤细菌减毒鼠伤寒沙门氏菌VNP20009(VNP)被封装在这些巨噬细胞中,形成R-GEM/VNP细胞。细胞内的细菌可以存活较长时间并实现延迟释放。
此外,制备了含有干扰素γ表达VNP菌株(VNP-IFNγ)的工程化R-GEM/VNP-IFNγ细胞,其能够通过巨噬细胞趋化性和RGD介导的粘附有效地聚集在肺转移瘤内。释放的VNP-IFNγ菌株通过增强抗肿瘤免疫反应来抑制肿瘤进展。与直接注射细菌相比,
该方法利用R-GEM介导的伪装和肿瘤靶向递送,显著提高了瘤内的菌株浓度及其生物相容性,从而扩大了传统微生物免疫疗法的治疗窗口。
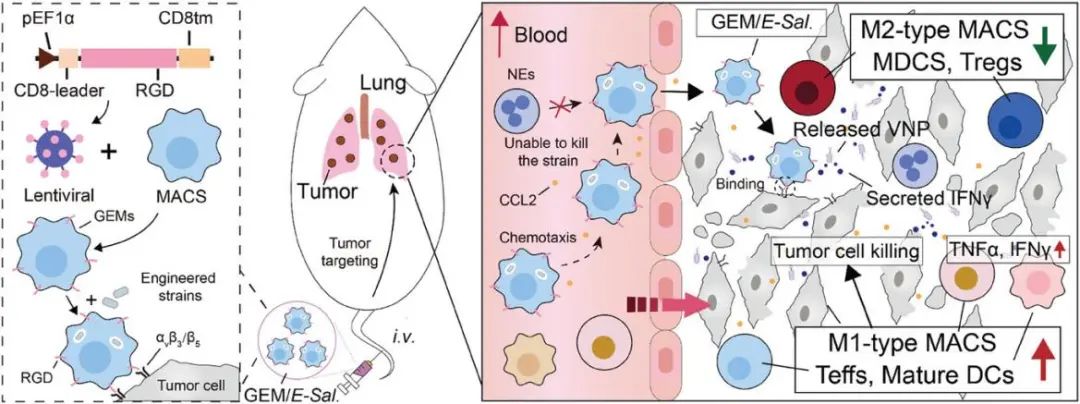
机理图:双工程巨噬细胞-微生物封装(Du-EMME)工作机理示意图
文献来源链接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202406140




